단백질은 세포주기 (Cell cycle) 조절, 신호전달 (Signal transduction), 세포사멸 (Cell death), DNA 복제 등과 같은 세포 내에서 일어나는 여러 주요한 대사 기작을 조절하는 중요한 기능을 담당하고 있다. 이러한 단백질들이 어떻게 활성화되고, 비활성화 되는지를 살펴 봄으로써 궁극적으로 이러한 단백질들에 의해서 조절되어지는 세포물질 대사 기작에 대한 이해를 높일 수 있게 된다.
세포 내에서 단백질 합성 후 그 활성을 조절하는 기작 (Post-translational modification)의 하나로, 진핵생물에서 보여지는 단백질 분해기작 (Proteolysis) 이 있다. 이 과정은 매우 선택적이며 정교하게 조절되는데, 대부분의 세포 단백질 (약 80%)은 ubiquitin에 의해 표지된 후 proteasome에 의해 세포질과 핵에서 정교한 조절을 통해 분해되며 이 과정을 Ubiquitin Proteasome System (UPS)라 한다.
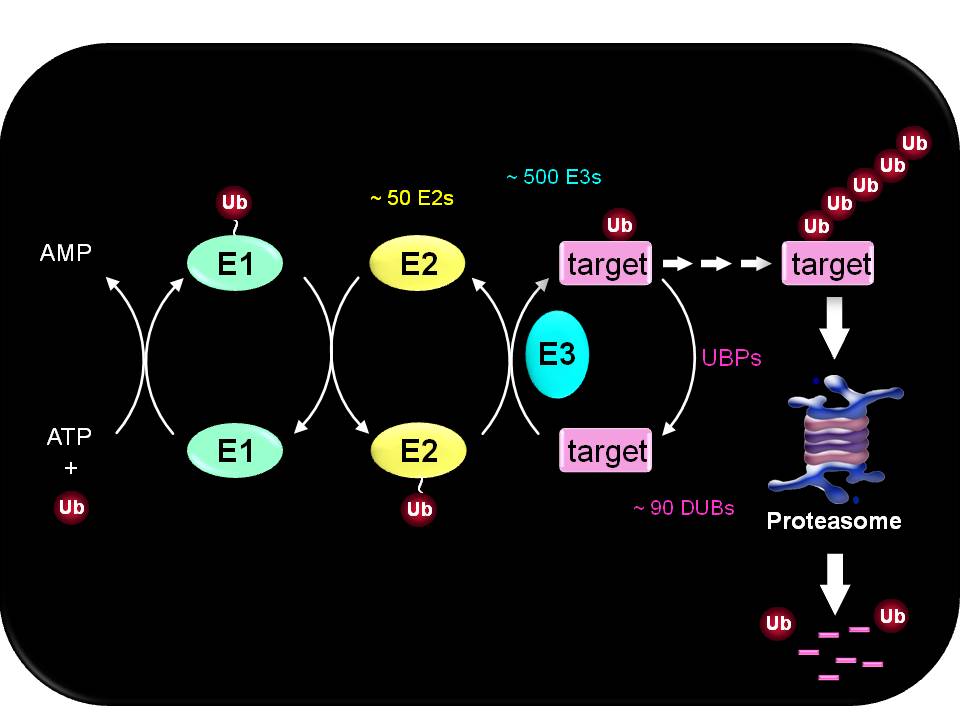
UPS는 기질단백질에 76개의 아미노산으로 이루어진 ubiquitin이 공유결합을 통해 표지되고 이를 26S proteasome이 인지하여 분해하는 기작이다. 기질단백질에 ubiquitin이 표지되는 과정 (ubiquitination)은 세 가지 효소 (E1, E2, E3)의 연속적인 반응에 의해서 일어난다. Ubiquitin-activating enzyme (E1)은 ubiquitin-C-terminal Gly과 E1의 Cys를 연결하는 high-energy thiol ester bond를 통해서 ATP 의존적 반응으로 ubiquitin을 활성화 시킨다. Ubiquitin-conjugating enzyme (E2)는 E1 으로부터 활성화된 ubiquitin을 받아서 다시 thiol ester bond를 형성하게 되고, 이렇게 활성화된 ubiquitin은 E3 ubiquitin ligase에 전달되거나 또는 기질 단백질 (Lys ε-amino residue)에 직접 전달된다. 이때 E3 ubiquitin ligase는 기질 단백질과 ubiquitin 사이의 isopeptide bond의 형성을 촉매 한다. 기질 단백질에 결합된 ubiquitin의 internal Lys residue에 또 다른 ubiquitin이 연결되어 polyubiquitin chain을 형성하게 되면, 이를 26S proteasome이 인식하여 단백질을 선택적으로 분해하게 된다. 세 가지 효소 중 E3 ubiquitin ligase는 분해될 기질 단백질을 인식하는데 가장 중요한 역할을 한다.
본 연구실에서는 Ub-의존적 단백질 분해기작 (Ub-dependent Proteolysis) 및 세포주기 동안 단백질 분해 기작에 의해 야기되는 조절 기작에 대해 집중적으로 연구하고 있으며,이를 통하여 특정 단백질에 의해 유도되는 세포내 특정 대사 기작이 어떻게 조절되어지는 지를 규명하는 연구를 수행하고 있다.
