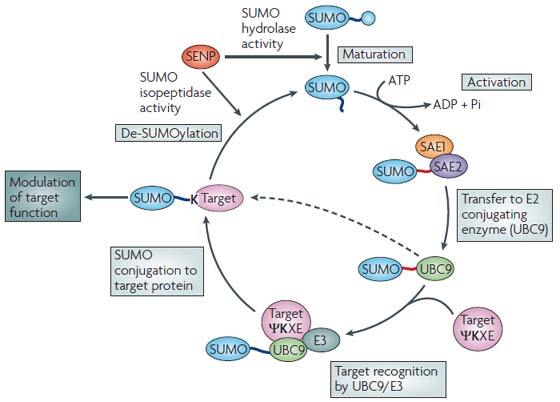
Ubiquitin과 서열유사성을 가진 단백질로 처음 알려진 SUMO (Small ubiquitin related modifier) 는 많은 단백질에 결합되지만 Ubiquitin의 일반적인 기능인 proteasome을 통한 단백질의 분해를 유도하지는 않는다. SUMO의 결합을 통한 변형 (Sumoylation 이라고 함) 이 일어나는 표적은 유전자의 전사조절 관련 단백질들이 많이 보고되어있다. 많은 경우 Sumoylation은 관련 전사인사의 전사활성을 억제한다고 알려져 있으며 세포내 위치를 변화시키고 단백질의 이동을 유도하기도 한다.
Ubiquitination 이나 phosphorylation 이 단백질의 기능을 On-Off 시키는 경로라면 Sumoylation은 표적이 되는 단백질의 기능에 있어서 강도를 조절하는 수단이 되는 것으로 보여진다. 이러한 조절은 여러 단백질의 세포활성조절에 있어서 미세조정이 일어나게 하는 수단이 된다. 세포가 정상적으로 분열하고 분화하기 위해서는 정확하고 잘 통제된 전사조절이 중요한데 Sumoylaiton은 이러한 fine-tuning이 가능하게 하는 수단이 된다. 실제로 proteomics 연구를 통한 예측에서 전사조절과 관련된 단백질의 약 50% 정도가 Sumoylation 될 것이라고 보고된 바 있다.
Sumoylation은 Ubiquitin과 유사하게 precursor형태로 말단에 4개의 잉여 아미노산을 가지고 발현된다. 이는 SUMO 특이적인 분해효소 (SUMO specific protease, SUSPs) 에 의해서 절단된 후 conjugation을 유도하는 효소들의 작용으로 표적에 결합하며 이는 분해효소 (SUSP) 를 통해 다시 제거될 수 있는 가역적인 과정이다.
본 연구실에서는
1. SUMO의 결합이 일어나는 표적단백질을 찾고
2. 표적단백질의 활성 변화를 측정하고 이것이 어떤 메커니즘을 통해 이루어지는지
3. SUMO를 표적단백질로 부터 유리 (desumoylaiton) 시키는 특이적 분해효소 (SUSPs) 찾고
4. Sumoylation 과정과 desumoylation 과정을 통한 세포의 생리적인 변화를 확인하고
5. 이의 조절을 통해 세포분화나 질병치료에 응용하고자 하는 연구를 수행한다.
p53 암 억제 단백질은 세포의 성장, 분화 등의 조절에 중요한 역할을 하고 있다. p53은 정상상태에서는 적은 양으로 존재하지만, 세포가 DNA damage같은 스트레스를 받으면 세포주기억제, DNA repair, 또는 apoptosis등에 관여하는 단백질의 전사를 높이는 활성을 모이며 세포내에서 그 양이 증가한다. 그러므로 p53의 단백질 레벨을 정교하게 조절하는 것이 세포내 여러과정의 조절에 중요하다. P53의 중요한 조절 인자중에 하나가 Mdm2로, 이는 p53의 ubiquitin ligase로 ubiquitination과 분해에 관여한다. Mdm2는 또한 자기자신을 ubiquitination시킬 수 있다. 동시에 Mdm2 유전자는 p53의 target 유전자로 그들은 negative feedback loop를 형성한다. 여러 mechanism에 의해서 이러한 loop는 조절 받게된다. Post-translational modification이나 다른 factor들간의 결합으로 인해 그의 세포내 분포가 달라지기도 한다. 그러나 Mdm2가 p53 ubiquitination과 self-ubiquitination 사이에서 어떻게 전환하는 지에 대해서는 알려진 바가 없다.
p53은 SUMO-1에 의해서 결합되며, SUMO-1과 Ubc9이 과발현되었을 때 p53-dependent transcription의 변화에 대해서는 아직 논란의 여지가 많다. Mdm2 마찬가지로 SUMO-1이 결합하며, 그 기능에 대해서도 알려진 바가 없다. 이에 우리는 새로은 SUMO 특이적 단백질 분해효소, SUSP4가 Mdm2와 p53에 결합되어 있는 SUMO를 제거할 수 있다는 것을 발견하였다. 또한 SUSP4에 의한 Mdm2의 desumoylation은 그의 self-ubiquitination을 증가시켜 proteasome에 의한 분해를 촉진시킨다. 이것은 p53의 transcriptional activity를 증가시키는 결과를 가져온다. 이 같은 결과들은 Mdm2의 sumoylation과 desumoylation이 p53 ubiquitination와 mdm2 self-ubiquitination사이의 스위치로 작용할 수도 있다는 것을 시사한다. 이에 우리는 이러한 과정중에 SUSP4의 관여에 대해 연구 중이다.
생체 내에서 발현되는 유전자 중에 CAG repeat을 많이 가지는 유전자들이 있는데 이들 유전자들은 부분적인 hairpin 구조를 형성하여 DNA polymerase의 진행을 방해하며 경우에 따라서는 DNA polymerase가 미끌어져서 CAG repeat의 비정상적인 증폭을 야기시킨다. CAG codon은 glutamine을 coding하기 때문에 CAG repeat이 증폭된 유전자들은 poly-glutamine repeat을 가지는 단백질을 발현시킨다. PolyQ repeat을 가지는 단백질들은 비정상적인 folding을 가지기 때문에 본래의 기능을 상실하거나 (loss-of-function), 세포 내에서 해로운 기능을 획득하여 (gain-of-function) 세포를 사멸하도록 유도한다. PolyQ repeat을 가져서 질병을 유발시키는 단백질로 알려진 것으로는 헌팅턴병을 유발시키는 huntingtin, SCA를 유발시키는 ataxin계열 단백질, DRPLA를 유발시키는 atrophin-1, SBMA를 유발시키는 androgen receptor가 있다.
Misfolding된 polyQ protein은 ubiquitination 되어서 세포 내에서 제거되어야 하는데 단백질이 지나치게 많이 누적되면 ubiquitin-proteasome system (UPS)가 제대로 작동하지 못하게 되어 misfolded protein이 세포 내에 응축된다. 그리고, 최근에 알려진 바에 의하면 일부 polyQ protein이 sumoylation 되며 sumoylation이 유도되면 병의 진행이 더 빨라지며 UPS보다 sumoylation이 병의 진행에 더 중요한 역할을 한다. Huntingtin의 경우 ubiquitination residue와 sumoylation residue가 동일한데, 초파리의 헌팅턴병 모델에서 sumo를 knockout한 경우 병의 진행이 상당히 느려진데 비해서 ubiquitin을 knockout한 경우에는 병의 진행이 근소하게 빨라진다. Sumoylation residue와 ubiquitination residue가 동일하므로 두 modification system을 전환시키는 효소가 있을 것으로 생각되어지며 desumoylating enzyme과 deubiquitinating enzyme이 핵심적인 기능을 할 것으로 생각된다. 이들 효소를 발굴하여 polyQ disease에 어떤 영향을 미치는 가를 연구하고자 한다.
