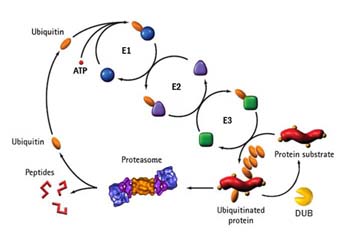
유비퀴틴, 유비퀴틴화, 탈유비퀴틴화
유비퀴틴은 그 이름에서도 알 수 있듯이 모든 진핵생물에서 발현되는 단백질이다. 이 유비퀴틴은 76개의 아미노산으로 이루어진 작은 단백질로 다른 단백질에 공유결합이 되는 특성을 가지는데, 이를 “유비퀴틴화”라고 한다. 유비퀴틴화가 되는 기질 단백질은 매우 다양하여, 세포내의 거의 모든 생리활동이 유비퀴틴화에 연관이 있으며, 많은 질병이 유비퀴틴화가 잘 이루어지지 않아 일어난다. 유비퀴틴은 그 기질로 유비퀴틴 스스로를 가지며, 이것은 공유결합으로 서로 연결된 유비퀴틴 사슬을 형성할 수 있다. 따라서 세포내 에는 유비퀴틴 단위체 및, 하나의 유비퀴틴이 공유결합된 단백질, 유비퀴틴 사슬이 결합된 단백질, 그리고 유비퀴틴 사슬등의 형태가 존재한다.
단백질 유비퀴틴화의 기능
다른 여타의 번역 후 단백질 수식과정과 마찬가지로 유비퀴틴화는 기질의 기능이나 생리활동을 변화시킨다. 가장 잘 알려진 유비퀴틴화의 기능으로는 유비퀴틴의 48번째 라이신 을 통해 형성된 유비퀴틴 사슬에 의한 것인데, 이러한 48번 유비퀴틴 사슬이 붙은 단백질은 단백질 분해효소 복합체인 26S 프로테아좀에 의해 인식되어 특이적으로 분해되고, 유비퀴틴 단위체들은 재활용된다.
유비퀴틴화의 메커니즘
유비퀴틴화는 E1-E2-E3 연쇄 효소 반응에 의해 이루어지는데, 각각 유비퀴틴 활성화, 유비퀴틴 결합 – 유비퀴틴 연결의 반응이다. 인간 세포 내에는 하나의 유비퀴틴 활성화 효소와 34이상의 유비퀴틴 결합효소, 500개 이상의 유비퀴틴 연결효소가 존재한다.
이러한 E1-E2-E3 메커니즘을 밝히는데 기여한 공로로 2005년도 노벨상이 A. Hershko, A Ciechanover, I. Rose 에게 수여 되었다
탈-유비퀴틴화
탈 인산화와 마찬가지로 공유결합된 유비퀴틴은 그 기질로부터 제거될수 있는데, 이러한 반응을 수행하는 효소가 “탈유비퀴틴화 효소 (DUBs)” 이다. 이러한 탈 유비퀴틴화 효소는 유비퀴틴 전구체로부터 유비퀴틴 단위체를 형성하거나 (UCHs), 유비퀴틴 사슬(UBPs)을 분해하기도 한다. 탈 유비퀴틴화 효소에는 크게 네가지 family가 존재하며 각각은 UCHs, UBPs, Otubain Family, JAMM family 이다.
-------------------------------------------------------------------------------------
유비퀴틴은 E1,E2,E3을 통한 일연의 효소작용으로 단백질에 결합한다. 이 중 E3는 기질 특이성을 갖고 있으며 ,E6AP와 유사한 HECT-domain을 갖는 그룹과, 유비퀴틴의 결합에 매우 중요한RING-finger domain을 갖는 그룹으로 크게 나우어 볼 수 있다. 가장 잘 알려진 RING 타입의 E3는 SCF (Skp1/Cul1/F-box)로서, 이 중 Cul1은 중심골결을 이루어 Skp1과 RING-finger 단백질인 Roc1과 결합한다. F-box 단백질은 Skp1에 결합하므로서 함께 E3를 이루게 된다.
Cul 단백질은 지금까지 약 6개가 동정되어 Cul1, Cul2, Cul3, Cul4A, Cul4B, Cul5 등이 알려졌다. 이중에서 Cul3는 cyclinE의 분해를 매개하는 것으로 알려져 있었으나 Cul3를 포함하는 E3의 단백질들은 지금까지 발혀지지 않았었다. 그러다가 최근에 BTB domain을 갖는 단백질 그룹이 Cul3과 결합하는 것이 발혀졌다. 전부는 아니지만 대부분의 BTB 단백질은 BTB 이외에 Zn finger, Keltch repeat, MATH등 다른 단백질들과 결합할 수 있는 부분을 갖고 있다.
이런 가운데 일부 BTB 단백질들인 Cul3와 결합하면서 기질 특이성을 결정하는 역할을 한다는 것이 확인되었다. 예를 들어 사람의 SPOP와 유사한 C. elegans의 MEL26는 MEI-1과 특이적으로 결합하면서 Cul3에 의한 유비퀴틴의 결합을 유도하여 분해되도록 하는 역할을 한다. MEI1-은 사람에서의 Katanin과 유사한 단백질로서 microtuble을 단량체로 만드는 MEI-1/MEI-2를 이루는 단백질로 감수분열동안 염색체와 방추체에 위치한다.SPOP BTB 단백질은 Polycomb group BMI와 히스톤의 한 변종인 MacroH2A의 유비퀴틴 결합을 매개하는 것으로 알려졌다. Keap1 BTB 단백질은 Nrf2를Cul3 와의 결합을 매개하는 것으로 알려졌다. Nrf2는 전사인자로 산화 스트레스 하에서 항산와 유전자의 발현을 조절한다. S. pombe 에서 Btb1p, Btb2p, Btb3p가 Cul3와 결합하는 것으로 알려져 있으나 그들의 역할은 아직 발혀지지 않았다. 즉, 지금까지 BTB 단백질을 통해서 Cul3가 주를 이루는 E3 효소에 의해 유비퀴틴이 결합되고 분해되는 기질은 매우 소수만이 밝혀진 상황이다.
Daxx는 yeast two-hybrid 스크리닝 방법으로 Fas 수용체의 death domain과 결합하는 단백질로 처음 발견되었다. Daxx는 ASK1과 결합해서 JNK를 활성화 함으로써 Fas에 의해 매개되는 세포사멸을 촉진한다. 이후의 연구들은 여러가지 스트레스 상황에서 세포사멸을 촉진하는(pro-apoptotic)는 단백질로 역할한다는 것을 보여주고 있다. 그러나 Daxx의 유전자를 모두 없앴을 때 오히려 세포사멸이 과촉진되어 배아가 죽는 것이 확인되어 Daxx가 세포사멸을 억제하는(anti-apoptotic) 단백질임이 밝혀지기도 하였다. 우리 실험실에서는 Daxx가 세포사멸을 억제하는 단백질임을 보여주는 연구를 진행하여 입증한 바 있다.
Daxx는 세포내에서 전사에 관여하는 많은 핵내 세포와 결합하여 전사를 조절하는 역할을 한다. Daxx는 HDAC-II, core histones 뿐만 아니라 염색체와 결합하고 있는 단백질인 D다과 결합하고 있으며 이는 Daxx가 염색체의 재구성을 통해서 전자를 억제한다는 것을 말해준다. 또한 Pax-3,Pax-7과 함께 결합체를 이루어 전사를 억제하는데 alveolar rhabdomyosarcoma (폐포 횡문근육종양 세포) 에 존재하는 Pax-3/FKHR 비정상 융합 단백질은 Daxx의 이런 억제 기능에 대한 내성을 갖고 있다.
이와 유사하게 Daxx는 MMP1 유전자를 활성화하는ETS1과 결합하므로써 이의 작용을 억제한다. 또한 p53의 증가에 의한 세포의 죽음을 억제하는데, 이는 p53에 의해 매개되는 세포의 스트레스 반응을 억제하는, p53의 억제조절인자로 작용하기 때문이다. 흥미로운 점은 HeLa 세포에서Daxx가 actinomycin D, UV 에ㅡ이해서 세포내 양이 감소한다는 것이다. 최근에는 SPOP과 결합한다는 연구보고가 있었다. 이는 Daxx의 억제조절의 기능이 Daxx를 분해하는 기작에 의해 조절될 수 있음을 시사해주고 있다.
우리는 SPOP가 Daxx와 매개해서 Cul3를 통해 유비퀴틴의 결합을 촉진하고 궁극적으로 프로테아좀에 의해 분해되도록 한다는 것을 밝혀내었다. 게다가 SPOP/Cul3를 통한 Daxx의 분해는, Daxx로 인한 ETS1과 p53의 전사 억제를 다시 복구할 수 있음을 확인하였으며, Daxx의 분해사 apoptosis를 유발하는 것을 증명하엿다. 이렇게 볼 때, SPOP/Cul3의 E3 효소는 세포내 Daxx의 양을 조절하는데 중요 역할을 하며 Daxx를 통한 전사조절 및 세포 사멸등의 여러가지 세포내 메커니즘에 관여한다는 것을 알수 있다.
최근 우리의 또 다른 연구는 Daxx의 유비퀴틴의 결합과 분가 USP계열에 의해 역으로 진행될 수 있는 가능성을 확인하였다. USP에 의한 Daxx의 안정화와 이로인한 Daxx의 전사억제를 조절하는 메커니즘은 현재 연구가 진행 중이며 아울러 Daxx의 SUMO 결합과 인산화 역시 함께 연구되고 있다.
